高三 化学(等级考)试题
相对原子水平:H-1 C-12 O-16 Al-27 S-32 Ca-40 Ba-137
1、选择题
1. 下列物质是电解质的是( )
A. 饱和食盐水 B. 二氧化碳
C. 石墨 D. 硫酸钡
2. 下列变化中不是固氮的是( )
A. 在肯定条件下由氨气和二氧化碳合成尿素
B. 雷雨闪电时,大方中产生了一氧化氮
C. 豆科植物的根瘤菌从空气中获得氮肥
D. 镁条在氮气中燃烧生成氮化镁
3. 常温下,下列溶液可以用铝制容器盛装的是( )
A. 稀硫酸 B. 浓硫酸 C. 盐酸 D. 氢氧化钠的溶液
4. 下列物质不可以由单质直接化合而成的是( )
A. Cu2S B. NH3 C. FeCl3 D. SO3
5.《新修草本》有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”据此推断“青矾”的主要成分为( )
A. CuSO4·5H2O B. KAl2·12H2O
C. FeSO4·7H2O D. CaSO4·2H2O
6. 下列反应中既是氧化还原反应又是吸热反应的是( )
A. 钠与水的反应 B. 灼热的木炭与 CO2 反应
C. 酒精的燃烧反应 D. 碳酸钙在高温下分解
7. 近年来发现的星际分子乙醇醛分子模型如图所示,有关乙醇醛说法肯定错误的是( )
A. 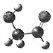 有 2 种含氧官能团 B. 能发生银镜反应
有 2 种含氧官能团 B. 能发生银镜反应
C. 与乙醛互为同系物 D. 与乙酸互为同分异构体
8. 短周期元素 X、Y、Z 在元素周期表中的地方如图所示,下列说法正确的是( )
A. 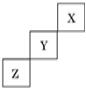 X、Y、Z 三种元素中,X 的非金属性最强
X、Y、Z 三种元素中,X 的非金属性最强
B. Y 的最高正化合价为+7 价
C. 常压下 X 单质的熔点比 Z 单质低
D. Y 的氢化物的热稳定性比Z 的氢化物弱
9. 下列物质中,含有非极性共价键的盐是( )
A. Na2O2 B. CH3COONa C. MgCl2 D. Na2SO4
10. 某稀氨水中存在平衡:NH3·H2O ![]() NH4++OH-,若想增大 NH4+的浓度,而不增加OH-的浓度,可以采取的手段是:
NH4++OH-,若想增大 NH4+的浓度,而不增加OH-的浓度,可以采取的手段是:
①适合升高温度;②加入NH4Cl 固体;③通入 NH3;④加入少量盐酸
A. ①② B. ②③ C. ③④ D. ②④
11. 肯定条件下,将 NO2 与 SO2 以体积比 1:2 置于恒容密闭容器中发生反应:
NO2+SO2 ![]() SO3+NO,肯定能说明反应达到化学平衡状况的是( )
SO3+NO,肯定能说明反应达到化学平衡状况的是( )
A. 体系压强维持不变 B. 混合气体颜色维持不变
C. SO3 和 NO 的水平比维持不变 D. v 消耗=v 生成
12. 在无色溶液中可以很多共存的离子组是( )
A. H+、Na+、NO3-、Cu2+ B. Ba2+、Mg2+、Cl-、SO42-
C. K+、Mg2+、NO3-、SO42- D. K+、Na+、OH-、HCO3-
13. 化学在生产和日常有要紧的应用,下列说法错误的是( )
A. 小苏打在日常可用做发酵粉
B. 过氧化钠可用于呼吸面具中氧气的来源
C. 可溶性铁盐或铝盐可用于净水
D. 碳酸钠常用于治疗胃病
14. 关于 2-苯基丙烯![]() )说法正确的是( )
)说法正确的是( )
A. 分子中所有原子共平面 B. 不可以使酸性高锰酸钾溶液褪色
C. 可以发生加聚反应 D. 易溶于水及甲苯
15. 互联网趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式。下列有关辛酸的叙述正确的是( )
A.  辛酸在常温下呈气态
辛酸在常温下呈气态
B. 辛酸的酸性比醋酸强
C. 辛酸在水中的溶解度小于醋酸
D. 辛酸和油酸(C17H33COOH)是同系物
16. 下图表示 0.1mol/L NaHSO3 溶液中三种微粒的浓度大小,以下剖析正确的是( )
A. 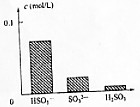 由于HSO3-的水解程度大于电离程度,所以溶液呈碱性
由于HSO3-的水解程度大于电离程度,所以溶液呈碱性
B. 由于 HSO3-的电离程度大于水解程度,所以溶液呈酸性
C. 由于 HSO3-的水解程度大于电离程度,所以溶液呈酸性
D. ![]() 由于HSO3 的电离程度大于水解程度,所以溶液呈碱性
由于HSO3 的电离程度大于水解程度,所以溶液呈碱性
17. 为提纯下列物质(括号内的物质为杂质),所使用的除杂试剂和离别办法都正确的是( )
选项 | A | B | C | D |
样品 | 乙醇(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰酸钾溶液 | KI 溶液 |
离别办法 | 蒸馏 | 分液 | 洗气 | 分液 |
18. 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中 N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法错误的是( )
A. 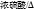 该反应中 Cl-为还原产物
该反应中 Cl-为还原产物
B. 氧化剂与还原剂物质的量比为 3:2
C. 消耗 1mol 还原剂,转移 6mol 电子
D. 氧化性:ClO-比N2 强
19. 某芳香族化合物甲的分子式为 C10H11ClO2,已知苯环上只有两个取代基,其中一个取代基为 Cl,甲能与饱和碳酸氢钠溶液反应放出二氧化碳,则满足上述条件的有机物甲的同分异构体数目为( )
A. 18 种 B. 15 种 C. 12 种 D. 9 种
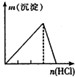
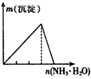
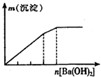
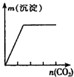
20. 下列实验与图象对应关系正确的是( )
选项 | A | B | C | D |
实验 | NaAlO2 溶液中逐滴滴加盐酸至过量 | AlCl3 溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加
Ba2 溶液至过量 | 澄清石灰水中缓慢通
入 CO2 至过量 |
图象 |
|
|
|
|
2、综合题
(一)氯气及其化合物在工农业生产和人类日常都有着要紧的应用。
21. HClO 中 Cl 的化合价为____________________,该分子的电子式为____________________。
22.“84”消毒液的主要成分为NaClO,该溶液呈____________________(填“酸性”、“中性”或“碱性”),其重要原因:
____________________(用离子方程式和必要的文字说明)。
23. 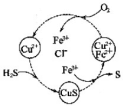 将 H2S 和空气混合后通入 FeCl3、FeCl2、CuCl2 的混合溶液中可以收购 S,物质转化如右图所示。在图示的转化中,化合价不变的元素有____________________。该 图示的总反应为____________________。
将 H2S 和空气混合后通入 FeCl3、FeCl2、CuCl2 的混合溶液中可以收购 S,物质转化如右图所示。在图示的转化中,化合价不变的元素有____________________。该 图示的总反应为____________________。
24. ClO2 气体可用于除去废水中的 Mn2+。
完成该反应的离子方程式,并用单线桥法标出电子的转移方向和数目。
____________________ClO2+____________________Mn2++____________________H2O→____________________Cl-+____________________MnO2+____________________
(二)甲醇是一种可再生能源,具备广泛的开发和应用前景。工业上使用反应Ⅰ合成甲醇:CO+2H2 ![]()
CH3OH+Q。
回答下列问题:
25. 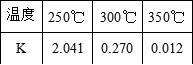 反应Ⅰ的化学平衡常数表达式为____________________。右表为该反应在不同温度下的化学平衡常数,由表 中数据判断Q____________________0(填“>”、“=”或“<”)。
反应Ⅰ的化学平衡常数表达式为____________________。右表为该反应在不同温度下的化学平衡常数,由表 中数据判断Q____________________0(填“>”、“=”或“<”)。
26. 某温度下,将 2mol CO 和 6mol H2 充入 2L 的密闭容器中,t min 后达到平衡状况,测得 c=0.2mol/L,用 H2 表示这期间内的平均化学反应速率为____________________。参照右表,此时的反应温度为____________________℃。
27. 为了提升 CO 的实际转化的比例,合成塔(恒容)中宜采取____________________手段(填写编号)。
a. 升高反应的温度 b. 提升 CO 的浓度
c. 使用更高效的催化剂 d. 提升 H2 的浓度
28. 工业上也可以通过 CO2 与H2 在肯定条件下反应(反应Ⅱ)合成甲醇,写出反应Ⅱ的化学方程式:
____________________。两种反应中符合“原子经济”原则的是反应____________________
(填“Ⅰ”或“Ⅱ”)。
29. 依据甲醇完全燃烧的原理,能将甲醇应用于燃料电池。反应的化学方程式:2CH3OH+3O2→2CO2+4H2O。此时,应将O2 通入燃料电池的____________________极(填“正”或“负”)。
(三)某学习小组设计实验探究 CuSO4 的固态和气态产物。
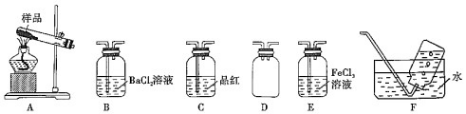
Ⅰ . 甲同学用下列装置探究气态产物中是不是含有 SO3、SO2 和 O2,并验证 SO2 的还原性。
 |
回答下列有关问题:
30. 上述装置按气流从左至右排序为:A、D、B、C、E、F,其中装置 D 有哪些用途可能是____________________
____________________。
31. 能证明有 SO3 生成的实验现象是____________________;能证明有 SO2 生成的实验现象是
____________________;能证明有 O2 生成的实验现象是____________________。
32. E 装置是为了验证 SO2 的还原性,写出可能发生的离子方程式:____________________。为了 确定该反应的发生,取 E 装置中反应后的溶液于试管中,设计如下实验:
a. 滴加少量的 NH4SCN 溶液;b. 滴加酸性 KMnO4 溶液;c. 滴加盐酸酸化的 BaCl2 溶液其中,策略适当的是____________________(填代号)。
33. 有同学觉得:只有证明生成 SO2,无需 F 装置就能证明O2 的生成,这种推断是不是合理,请说明你的原因____________________。
Ⅱ. 乙同学借助 A 中残留固体验证固体产物(假设硫酸铜已完全分解)。查阅资料知,铜有+2、+1 价。Cu2O 在酸性条件下不稳定,发生反应:
Cu2O+2H+→Cu+Cu2++H2O
34. 为了验证固体产物中是不是有 Cu2O,设计了下列 4 种策略,其中能达到实验目的的是____________________。甲:取少量残留固体于试管,滴加足量的稀硝酸,察看溶液颜色是不是变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,察看溶液颜色是不是变为蓝丙:取少量残留固体于试管,滴加足量的稀盐酸,察看是不是有红色固体生成丁:取少量残留固体于试管,通入氢气,加热,察看是不是生成红色固体
 |
(四)化合物 E 是合成香料、染料的中间体,一种合成路线如下:
回答下列问题:
35. A 中官能团名字为____________________,②的反应种类是____________________。
36. 分别写出反应②和反应④化学方程式。
反应②:____________________
反应④:____________________
37. 写出有机物 A 与足量NaOH 水溶液在加热时充分反应的化学方程式
____________________。
38. 写出D 的满足下列条件的同分异构体的结构简式____________________。
①能水解;②能发生银镜反应;③只含两种不同化学环境的氢原子注:两个—OH 连在同一个碳原子上不稳定
39. 乙酸甲酯(CH3COOCH3)可用作溶纤剂、喷漆溶剂,与用于制备人造革。设计由甲醇为起始材料制备乙酸甲酯(CH3COOCH3)的合成路线(无机试剂任选)。
![]() 合成路线常见的表示方法为:A ⎯⎯反应⎯物 ⎯® B ⎯⎯反应⎯物 ⎯® 目的产物(框外填写不能分)
合成路线常见的表示方法为:A ⎯⎯反应⎯物 ⎯® B ⎯⎯反应⎯物 ⎯® 目的产物(框外填写不能分)
 |
反应条件 反应条件
参考答案
1、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
D | A | B | D | C | B | C | C | B | D |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
B | C | D | C | C | B | A | C | B | C |
2、综合题
![]() (一)21. +1;
(一)21. +1;
22. 碱性;ClO-结合 H2O 电离出的 H+,形成 HClO,使溶液中 c>c,即 ClO-发生水解 ClO-+H2O ![]() HClO+OH-,使溶液呈碱性
HClO+OH-,使溶液呈碱性
23. Cu、H、Cl;2H2S+O2→2H2O+2S
24. 2ClO2+5Mn2++6H2O→2Cl-+5MnO2+12H+;电子转移方向和数目略
(二)25. K=
[CH3OH] ;>
![]()
![]() [CO] ×[H ]2
[CO] ×[H ]2
![]() 26. 1.6 mol/;250
26. 1.6 mol/;250
t
27. d
28. CO2+3H2→CH3OH+H2O;I
29. 正
(三)30. 防倒吸
31. B 中产生白色沉淀;品红溶液褪色;F 中有气泡产生32. 2Fe3++SO2+2H2O→2Fe2++SO42-+4H+;bc
33. 合理,生成 SO2 硫元素化合价降低,有元素化合价上升,即产物中有氧气
34. 丙
(四)35. 氯原子、羧基;取代反应
36. 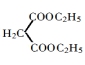 ClCH2COONa+NaCN→NCCH2COONa+NaCl
ClCH2COONa+NaCN→NCCH2COONa+NaCl
![]()
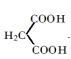 + 2CH3CH2OH + 2H2O
+ 2CH3CH2OH + 2H2O
37. ![]() ClCH3COOH+2NaOH ⎯H⎯2O⎯® HOCH3COONa+NaCl+H2O
ClCH3COOH+2NaOH ⎯H⎯2O⎯® HOCH3COONa+NaCl+H2O
HOOC-COOCH3 或 HCOOCHCHO
![]() CH3OH ⎯H⎯Cl® CH3Cl ⎯N⎯aCN⎯® CH3CN ⎯H⎯2SO⎯4 ® CH3COOH ⎯⎯CH3⎯OH ⎯® CH3COOCH3
CH3OH ⎯H⎯Cl® CH3Cl ⎯N⎯aCN⎯® CH3CN ⎯H⎯2SO⎯4 ® CH3COOH ⎯⎯CH3⎯OH ⎯® CH3COOCH3
(备注:第三步 H2SO4 可以写 H+)